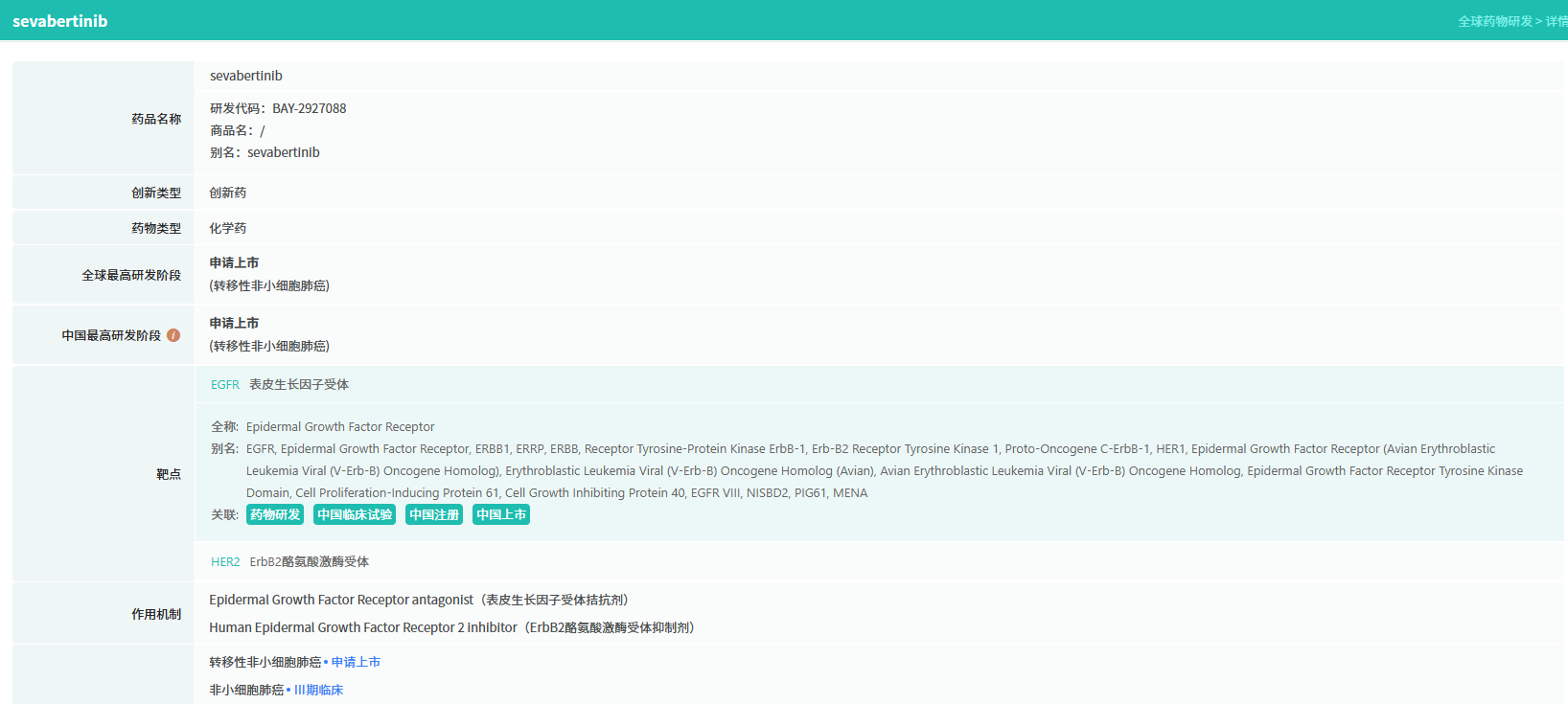
11月19日,FDA官网显示,拜耳的肺癌新药Sevabertinib(BAY 2927088)获批上市,用于治疗经FDA批准的伴随诊断设备证明肿瘤携带HER2(ERBB2)酪氨酸激酶结构域(TKD)激活突变并且接受过系统治疗的局部晚期或转移性非鳞状非小细胞肺癌(nsq-NSCLC)成人患者。此外,FDA批准了Life Technologies Corporation开发的Oncomine Dx Target Test作为伴随诊断设备。

研究的主要终点是BICR采用RECIST v1.1评估的确认客观缓解率(ORR)和缓解持续时间(DOR)。数据显示,在70例接受过系统治疗但未接受过HER2靶向药物治疗的患者中,ORR为71%,中位DOR为9.2个月,DOR至少达到6个月的患者比例为54%;在52例接受过包括HER2 ADC在内的系统治疗的患者中,ORR为38%,中位DOR为7.0个月,DOR至少达到6个月的患者比例为60%。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号