在生物制药领域,时常上演着跌宕起伏的故事,而Mike Grey拯救“我”(本文代指Maralixibat)的经历无疑是其中扣人心弦的篇章。

Mike Grey在制药行业堪称一位经验丰富的老将,拥有40年的深厚积淀。他曾在多家公司担任高级职位,如SGX Pharmaceuticals的总裁兼首席执行官(该公司于2008年被礼来公司收购)、Trega Biosciences的总裁兼首席执行官(2001年被Lion Bioscience收购)以及Biochem Therapeutic的总裁等。2011~2014年期间,他担任Lumena的总裁兼首席执行官,而这段经历为后来“我”的新主人Mirum Pharmaceuticals管线的发展埋下了伏笔。
Mike Grey
2014年Shire(已被武田收购)以2.6亿美元的价格收购Lumena Pharmaceuticals时获得了Maralixibat(当时代号为LUM001),彼时Shire对“我”寄予厚望,期望能在罕见肝病治疗领域有所建树,然而后续的研发进程却遭遇重创,“我”就此陷入长达4年的“冷冻期”。
药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据
:药品研发信息
2018 年,Mike Grey创立了Mirum Pharmaceuticals,且在放弃对该药物的控制4年后,凭借新的顶线数据,成功从Shire获得了“我”的全球独家许可权,并继续进行研究。Mirum Pharmaceuticals也由此开启了在罕见病药物研发领域的征程。凭借这一成果,公司募集到1.2亿美元的A轮融资,为公司后续发展注入了强大动力。
起死回生之后的“开挂药生”
“我”的商品名叫LIVMARLI,是一种口服、每日一次的回肠胆汁酸转运蛋白(IBAT)抑制剂,其作用机制是通过阻断胆汁酸肠肝循环,降低肝内和血清中的胆汁酸水平,进而减少由此介导的肝脏损伤,缓解瘙痒症状。
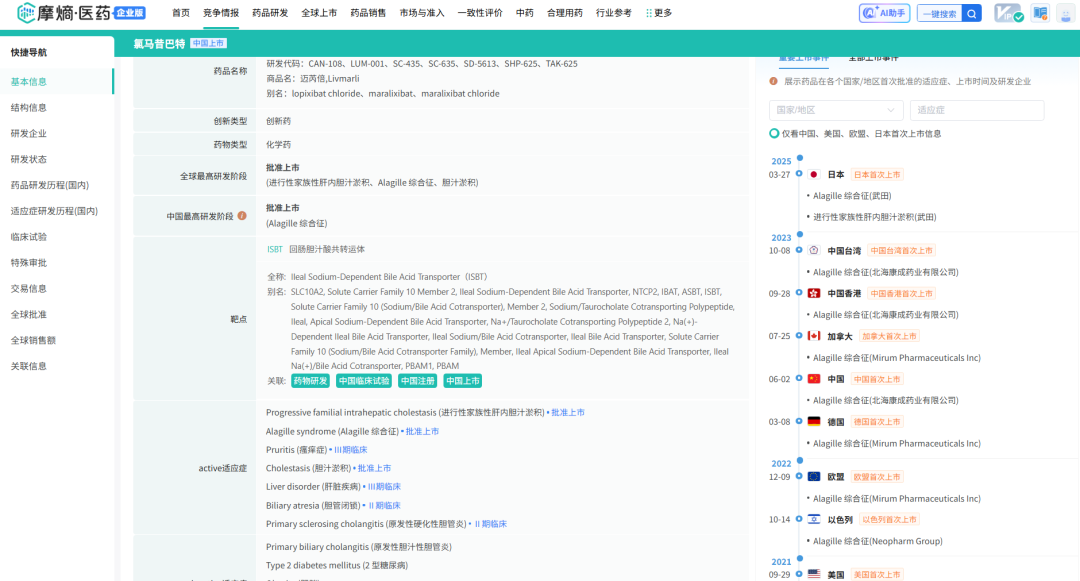
在适应症方面,“我”是首款获批用于治疗Alagille综合征(ALGS)患者胆汁淤积性瘙痒症的药物。在美国用于3个月及以上ALGS患者的胆汁淤积性瘙痒症;欧盟用于2个月及以上ALGS患者的胆汁淤积性瘙痒症;在加拿大用于1岁~18岁ALGS患者的胆汁淤积性瘙痒;在中国、以色列和韩国用于1岁及以上 ALGS患者的胆汁淤积性瘙痒症,其中,在中国由北海康成商业化,以色列由Neopharm商业化,韩国由GC Pharma商业化。
另外,“我”还被FDA批准用于治疗12个月及以上的进行性家族性肝内胆汁淤积症(PFIC)患者的胆汁淤积性瘙痒症,并在欧盟获批用于治疗3个月及以上年龄的PFIC患者。
公司目前在推进“我”用于其他适应症。通过名为EXPAND的临床试验3期研究,正在探索ALGS、PFIC、PSC、妊娠肝内胆汁淤积症和PBC以外的罕见胆汁淤积环境中瘙痒的治疗,预计2026年完成该试验的招募。
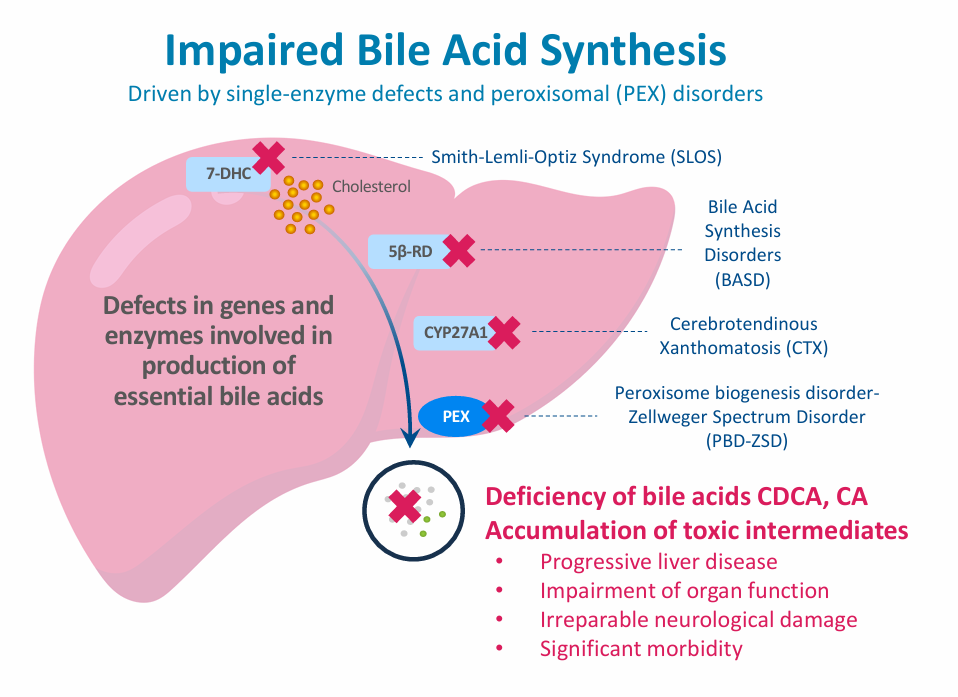
Mirum Pharmaceuticals其他获批产品CTEXLI(chenodiol)片剂也称为鹅脱氧胆酸(CDCA),是一种天然存在的胆酸,最初被批准用于治疗胆囊中放射性不透明结石患者,Mirum Pharmaceuticals发现其在治疗脑腱黄瘤病(CTX)方面具有潜力。其作用机制是通过补充患者体内缺乏的胆汁酸,助力清除有毒的胆固醇代谢物沉积,从而有效缓解CTX相关的临床症状。CTX是一种极为罕见的遗传代谢性疾病,由于CYP27A1基因突变,致使人体分解脂肪的关键酶出现缺乏。若得不到及时有效的治疗,患者将饱受慢性腹泻、青少年双侧白内障、肌腱黄瘤以及神经功能恶化等症状的折磨。

2024年6月,MirumPharmaceuticals向FDA提交了chenodiol用于治疗CTX患者的NDA,NDA的提交主要基于名为RESTORE的临床试验3期研究的结果,该研究评估了chenodiol在成人CTX患者中的效果,研究达到了主要终点,即患者的胆汁醇水平减少具有高度统计学显著性(p<0.0001);在随机双盲停药期结束时,安慰剂与chenodiol组之间的胆汁醇差异高达20倍;RESTORE研究还表明,chenodiol治疗也显著改善患者的血清胆固烷醇水平。2025年2月21日,FDA正式批准chenodiol上市,用于治疗成人CTX,为CTX患者带来了新的希望曙光,也标志着公司在罕见病治疗领域的又一重大突破。
另一个产品CHOLBAM(胆酸胶囊)最开始由Asklepion Pharmaceuticals研发,2015年3月获批上市;2015年Retrophin从Asklepion Pharmaceuticals收购了Cholbam;Mirum Pharmaceuticals后来又从Retrophin手中收购了包括Cholbam在内的胆汁酸产品组合。
Cholbam主要用于治疗者因单一酶缺陷导致胆汁酸合成障碍的儿童和成人患者,同时也可作为过氧化物酶体疾病(包括PBD-ZSD)患者的辅助治疗药物。它通过补充患者体内缺乏的胆酸,调节胆汁酸代谢平衡,从而改善相关症状。目前Cholbam已在市场上稳定销售,为相关罕见病患者提供了有效的治疗选择,在胆汁酸合成障碍及过氧化物酶体疾病治疗领域占据了一定的市场份额,为公司带来了持续的收入流。
深耕胆汁淤积,剑指FXS:药物新势力各展锋芒
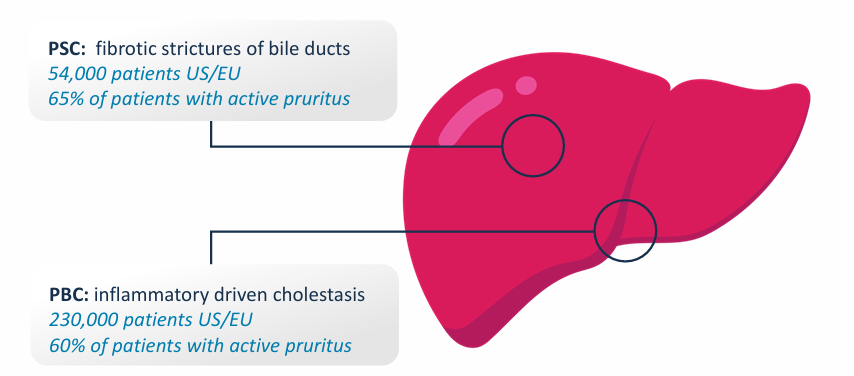
Volixibat是一种口服、最低吸收药物,同样旨在抑制IBAT,其作用机制与LIVMARLI类似,但在药物特性上有所差异,有望为不同患者群体提供更合适的治疗选择。目前正在两项临床试验2b期研究中进行评估,包括原发性硬化性胆管炎(PSC)的VISTAS试验和原发性胆汁性胆管炎(PBC)中的VANTAGE试验。

PSC是一种严重的特发性慢性胆汁淤积性肝病,其特征是胆管进行性炎症和破坏,可导致危及生命的并发症,高达65%的PSC患者在病程中患有瘙痒症。VISTAS试验是一项适应性、随机研究,旨在评估Volixibat对PSC和瘙痒患者瘙痒、sBA和纤维化标志物的影响,预计在2025年第三季度完成入组,2026年第二季度获得顶线数据。

PBC是一种慢性、罕见的胆汁淤积性肝病,其特征是免疫介导的肝内胆管破坏引起的进行性肝胆汁血流障碍,这会导致肝脏胆汁酸浓度增加,从而导致肝脏局部炎症反应,进展为肝纤维化、肝硬化和肝功能失代偿。VANTAGE研究预计在2026年完成入组。
MRM-3379是一种选择性PDE4D抑制剂,正在推进用于治疗FXS(脆性X综合征)。
FXS是一种由FMR1基因异常导致的遗传性疾病,主要是由于FMR1基因的5'端非翻译区存在CGG重复序列异常扩增,使得FMR1基因沉默,无法产生正常的脆性X智力低下蛋白,进而影响神经元的正常发育和功能,导致一系列的认知、行为和神经发育障碍症状。
PDE4D在大脑中对学习、记忆和情绪调节等非常重要的区域高度活跃,会分解(cAMP),而cAMP是神经细胞之间的一种关键信号分子,FXS患者的cAMP水平低于正常水平。MRM-3379可选择性地抑制PDE4D的活性,从而增加大脑中的cAMP水平,有助于重建受该疾病影响的大脑神经细胞通讯网络,进而可能缓解FXS的症状。
预计今年会启动MRM-3379的临床试验2期研究。
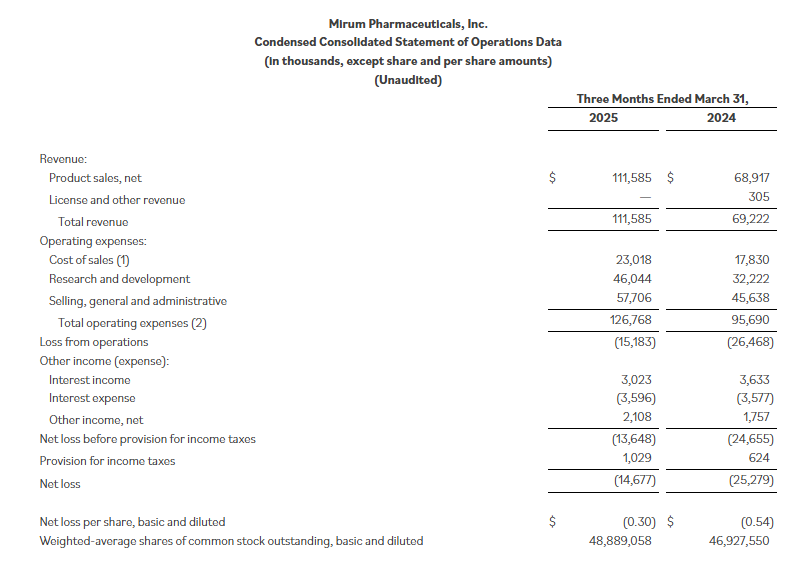
5月7号,“我”的主人Mirum Pharmaceuticals报道了今年第一季度的营收情况,截止2025年3月31日,公司拥有不受限制的现金、现金等价物和投资2.986亿美元。发稿前市值约合22亿美元。
2025年第一季度公司全球产品净销售额为1.116亿美元,上年同期只有6890万美元,其中“我”的净销售额为7320万美元,胆汁酸药物产品净销售额2840万美元。总运营支出为1.268亿美元,上年同期为9570万美元。
根据上一年统计,2024年全年产品净销售额为3.364亿美元,上年同期1.789亿美元,2024年度“我”的净销售额共计2.133亿美元,胆汁酸药物产品净销售总额1.231亿美元。2024年度全年总运营支出为4.245亿美元,包括7940万美元的非现金股票薪酬、无形摊销和其他非现金支出。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号