全球代谢疾病发病率近年来持续攀升,代谢功能障碍相关的脂肪性肝炎(MASH,以前称为NASH)作为一种严重的代谢性肝脏疾病,对人类健康构成了重大威胁,其防治工作迫在眉睫。Akero Therapeutics作为一家专注于严重代谢疾病治疗药物研发的临床阶段生物技术公司,凭借其在MASH治疗药物研发领域的积极探索与创新实践,逐渐崭露头角,公司不仅关注MASH,还计划通过技术创新和产品多元化,拓展到其他代谢性疾病领域。

Tim Rolph
2017年,风投机构Apple Tree Partners(ATP)与科学家Tim Rolph共同创立了Pippin Pharmaceuticals,即AkeroTherapeutics的前身。彼时,公司仅确定了聚焦代谢和心血管领域的发展方向,尚未拥有具体的技术与产品,但公司积极进取,迅速开启了产品引进和研发合作的征程,与安进的合作算是奠定了公司的管线基础(详见下文)。
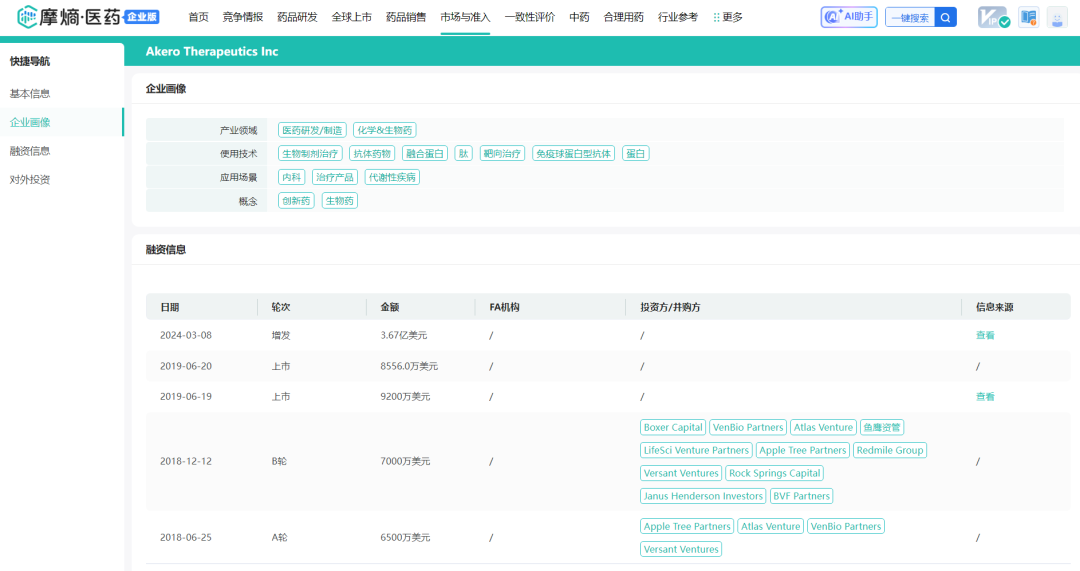
摩熵医药数据库:融资信息
随后,公司获得了ATP、Atlas Venture、venBio Partners、Versant Ventures四家专注生命科学领域投资机构领投的6500万美元A轮融资,为公司的研发注入了强劲动力;2019年,公司成功进行IPO,募资1.058亿美元,进一步充实了研发资金储备;2022年、2023年和2024年,公司分别融资2.3亿美元、2.2亿美元和3.67亿美元;2025年1月30日,AkeroTherapeutics宣布完成了普通股的后续发行,筹集了4.025亿美元的总收益。发稿前市值约34.47亿美金,约合250亿人民币。
截止2024年12月31日,AkeroTherapeutics的现金、现金等价物以及以及短期和长期有价证券为7.978亿美元,加上今年1月的募资,预计当前的现金、现金等价物以及短期和长期有价证券将足以支撑公司运营至2028年。

MASH是代谢功能障碍相关脂肪性肝病(MASLD)的一种严重形式,其特征是肝脏炎症和纤维化,可发展为肝硬化、肝功能衰竭、癌症和死亡。基于肝脏纤维化的程度MASH使用F0至F4范围内的等级进行评估,具体包括:(1)F0-F1:表示无纤维化或轻度纤维化。(2)F2-F3:表示中度或晚期纤维化;(3)F4:表示肝硬化。这种分期方法有助于评估疾病的严重程度和进展,并指导临床治疗决策。
2018年6月,Akero Therapeutics与安进签订了独家许可协议,根据该协议,Akero Therapeutics获得在美国和外国司法管辖区提交的由安进拥有或控制的专利的许可,独家许可专利包括但不限于Efruxifermin(EFX)的成分及其使用方法。EFX在安进公司时期代号为AMG-876,在2014年做完针对糖尿病患者的临床试验1期研究后便终止了,随后一直被搁置。Tim Rolph看中EFX在代谢疾病中的价值,随后对其开展研究。
2025年1月27日,Akero Therapeutics宣布在临床试验2b期的 SYMMETRY研究中,第96周时EFX对MASH引起的代偿期肝硬化(F4)发生了统计学意义逆转。这意味着EFX从MASH领域其他已批准或正在研究的治疗方法中脱颖而出,成为一种具有变革潜力的化合物。
Efruxifermin(EFX)是FGF21(成纤维细胞生长因子21)的类似物,FGF21是一种内源性表达的激素,可抵御细胞应激并调节全身脂质、碳水化合物和蛋白质的代谢,通过作用于不同的FGF受体(FGFR),介导对脂肪组织代谢的直接自分泌作用。
EFX经过工程改造,通过将半衰期从不到2小时延长到大约3天来克服内源性FGF21的局限性,同时保持FGF21在缓解细胞应激和调节全身代谢方面的天然作用。因此,EFX有可能解决MASH的潜在代谢疾病驱动因素,同时还可以逆转肝纤维化。
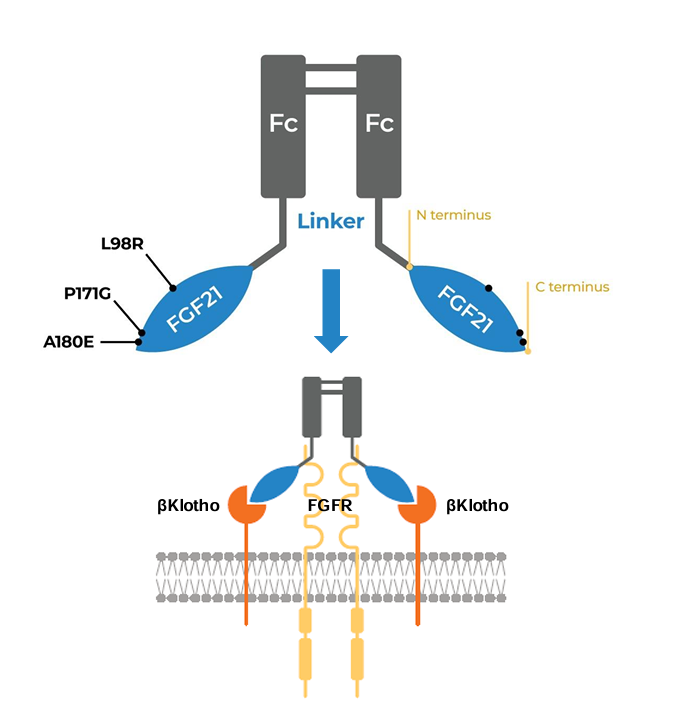
总的来看,与市场上同适应症产品相比,EFX具有以下亮点:(1)多重作用机制:EFX不仅能够减少肝脏脂肪和炎症,还能逆转纤维化,增加胰岛素敏感性并改善脂蛋白水平,提供全面的代谢改善;(2)显著的临床效果;(3)便捷的给药方式:EFX的半衰期较长,可以每周一次或每两周一次皮下注射,提高了患者的治疗依从性。
目前EFX正在评估五项随机、双盲、安慰剂对照临床试验的结果,根据目前报告的试验,共有385名患有MASH和/或2型糖尿病的成年患者接受了EFX治疗并评估了长达96周。

2025年1月,Akero Therapeutics报道了SYMMETRY试验第96周的初步顶线结果,这项临床试验2b期研究是为期96周的多中心、随机、双盲、安慰剂对照、剂量范围试验,评估了EFX在活检证实的MASH引起的代偿期肝硬化(F4,Child-Pugh A级)患者中的疗效和安全性。182例患者被随机分配接受每周一次的皮下注射28mg或50mgEFX或安慰剂。主要疗效终点是在第36周时纤维化至少达到一期改善且MASH没有恶化的受试者比例;关键的次要终点包括纤维化改善但MASH没有恶化,第96周时MASH消退没有纤维化恶化,以及第36周和第96周时肝纤维化和肝损伤的无创标志物、胰岛素敏感性和脂蛋白相对于基线的变化,以及安全性和耐受性的测量。
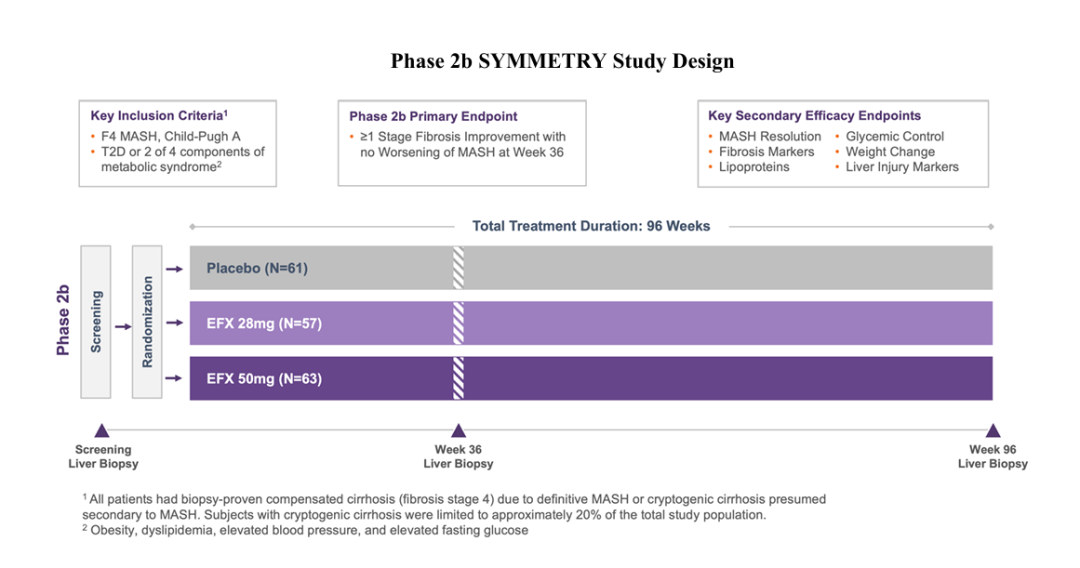
在第96周时,在基线和第96周活检患者中,39%接受50mg EFX治疗的患者经历了肝硬化逆转,MASH没有恶化,而安慰剂组为15%。通过意向治疗或ITT分析,所有缺失的第96周活检均被视为失败,50mg EFX患者中有29%经历了肝硬化逆转,脂肪性肝炎没有恶化,而安慰剂组约为12%。
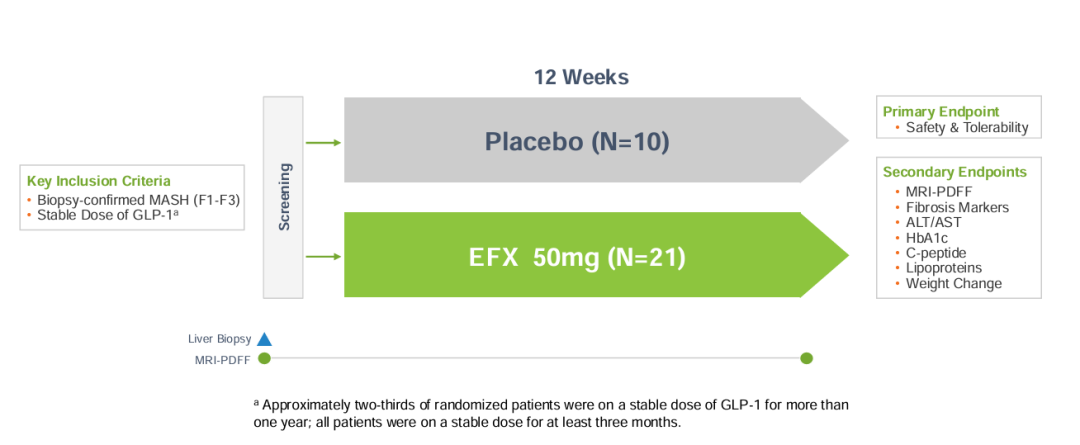
另外,SYMMETRY研究还包括一个扩展队列,称为队列D,主要评估EFX对已经接受GLP-1受体激动剂或GLP-1治疗的2型糖尿病患者的给药。队列D共招募了32例2型糖尿病和MASH引起的F1-F3肝纤维化患者,大约2/3的随机分组患者服用稳定剂量的GLP-1超过一年,所有患者均服用稳定剂量至少3个月。
结果显示:(1)EFX和GLP-1具有互补的作用机制;(2)在MASH和2型糖尿病患者中,将EFX添加到GLP-1的耐受性良好,没有附加的胃肠道副作用;(3)与单独使用GLP-1相比,含GLP-1的EFX显示出多种益处:减少肝脏脂肪变性、损伤和纤维化的标志物,改善血糖控制,维持血脂异常和体重减轻。
2024年3月,Akero Therapeutics报告了HARMONY试验第96周的初步顶线结果,这是一项临床试验2b期研究,旨在评估EFX在肝硬化前MASH(F2-F3)患者中的疗效和安全性。该研究的主要疗效终点是在第24周时纤维化至少达到一期改善而MASH没有恶化的受试者比例。关键的次要组织学终点包括无纤维化恶化的MASH消退,第24周和第96周时MASH消退和纤维化改善的复合终点,以及第96周时纤维化改善而MASH无恶化。其他次要指标包括肝脏脂肪相对于基线的变化、肝纤维化的无创标志物、血糖控制、脂蛋白和体重,以及安全性和耐受性测量。
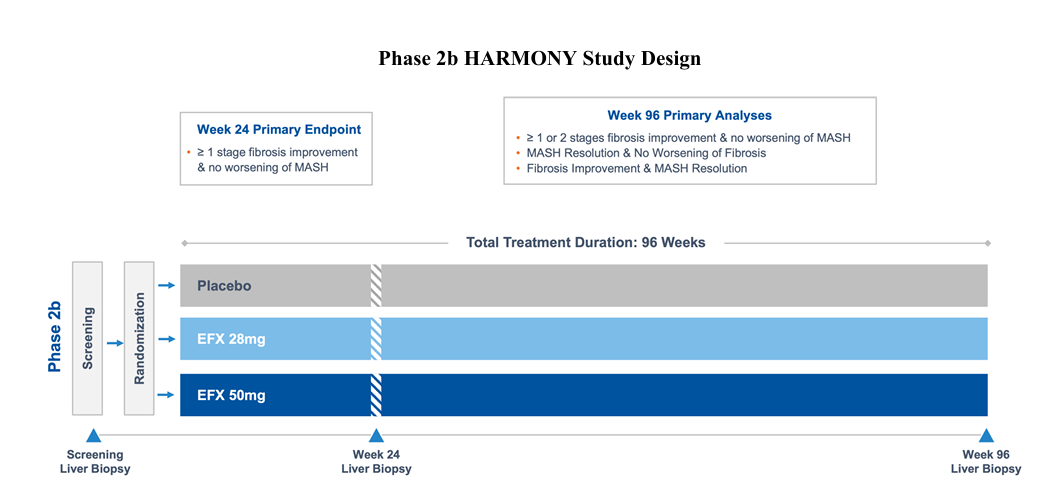
该试验先前达到了其主要终点,即50mg EFX(41%,p<0.001)和28mg EFX(39%,p<0.001)剂量组在治疗24周后纤维化改善≥1期,MASH没有恶化,而安慰剂组为20%;在第96周时,接受50mg EFX和28mg EFX治疗的患者中有36%和31%的纤维化改善了2期,而MASH没有恶化——这是安慰剂率3%的10倍以上。
2024年第四季度,Akero Therapeutics还开始了SYNCHRONY多项试验项目的入组,这项临床试验3期研究包括SYNCHRONY Outcomes、SYNCHRONYHistology和SYNCHRONY Real-World三项试验。
其中,SYNCHRONY Outcomes是一项双队列试验,评估EFX治疗因MASH引起的代偿期肝硬化(F4,Child-Pugh A 级)患者,患者每周接受EFX 50mg或安慰剂注射。仅针对队列1的主要组织学终点是治疗96周后纤维化改善≥1期且脂肪性肝炎无恶化的患者比例;队列1和队列2中入组的所有患者的主要结果终点是从随机分组到首次出现任何方案指定的临床事件的时间。
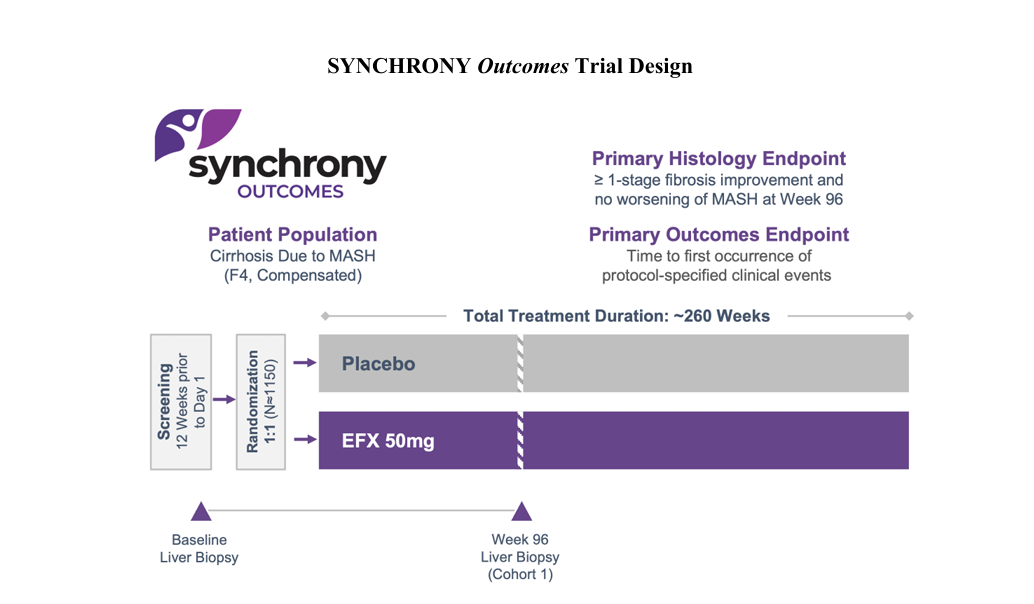
SYNCHRONYHistology是一项双队列试验,评估EFX治疗肝硬化前MASH(F2-F3)患者,患者每周接受28mg、50mgEFX或安慰剂注射。队列1和队列2中的所有患者都将接受长达240周治疗的长期临床结果评估。SYNCHRONYHistology研究的52周主要组织学终点预计将于2027年上半年出结果。

SYNCHRONY Real-World正在评估EFX治疗MASH(F1-F4,代偿)患者,安全性和耐受性的主要终点将在治疗52周后进行评估。2025年1月,公司宣布完成SYNCHRONY Real-World双盲部分的注册。SYNCHRONY Real-World试验的结果预计将于2026 年上半年公布。
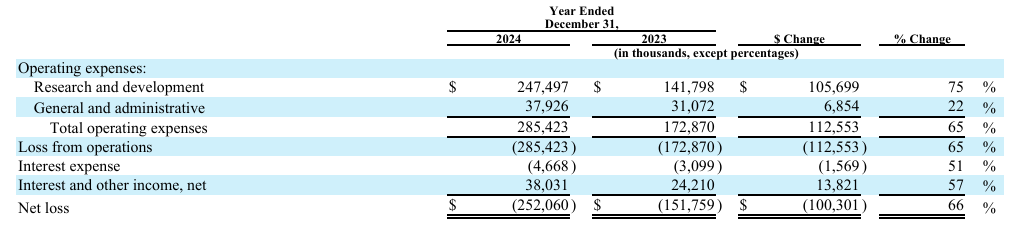
2024年度,Akero Therapeutics的研发费用2.475亿美元,上年同期为1.418亿美元。一般和行政费用为3790万美元,总运营支出为2.854亿美元。
截止2025年3月19日,公司总市值为35.65亿美元。
目前Akero Therapeutics尚未实施重大的并购活动。但从公司所处的发展阶段以及行业整体发展趋势来看,未来公司极有可能通过并购手段来拓展业务版图。在MASH治疗领域,公司可能会并购一些拥有相关前沿技术或在临床试验方面取得一定阶段性成果的小型生物技术公司,借此获取其关键技术、优质产品管线或专业研发团队,从而进一步加速自身在MASH治疗领域的战略布局。在拓展其他代谢疾病治疗领域时,公司也可能通过并购相关公司,快速切入新的市场领域,实现多元化发展战略。
通过合理规划和实施并购战略,相信Akero Therapeutics能够高效整合各方资源,显著提升自身综合实力,在激烈的市场竞争中占据更为有利的地位。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 2 Qiande Road, Life Science High Tech Zone, Jiang Ning District, Nanjing, Jiangsu Province, China